
近日,士泽生物医药(苏州/上海)有限公司(Roche Accelerator Member;以下简称“士泽生物”)与上海市东方医院(同济大学附属东方医院)(以下简称“东方医院”)“临床级iPSC衍生亚型神经前体细胞治疗渐冻症(肌萎缩侧索硬化症)的临床研究”项目启动会在上海市东方医院本部会议室正式召开。临床研究合作项目承办方上海市东方医院名誉院长、俄罗斯工程院院士、上海干细胞临床转化研究院院长刘中民教授及团队代表,合作方士泽生物创始人李翔博士及团队代表共同出席本次启动会。2024年1月30日,临床项目正式启动招募。
此前,士泽生物自主研发的临床级iPSC衍生亚型神经前体细胞药治疗渐冻症已获美国FDA认证并授予全球首发孤儿药(Orphan Drug Designation,ODD;FIC)资格,享有获批上市后7年市场独占权、加速审批及减免部分临床试验等资质:

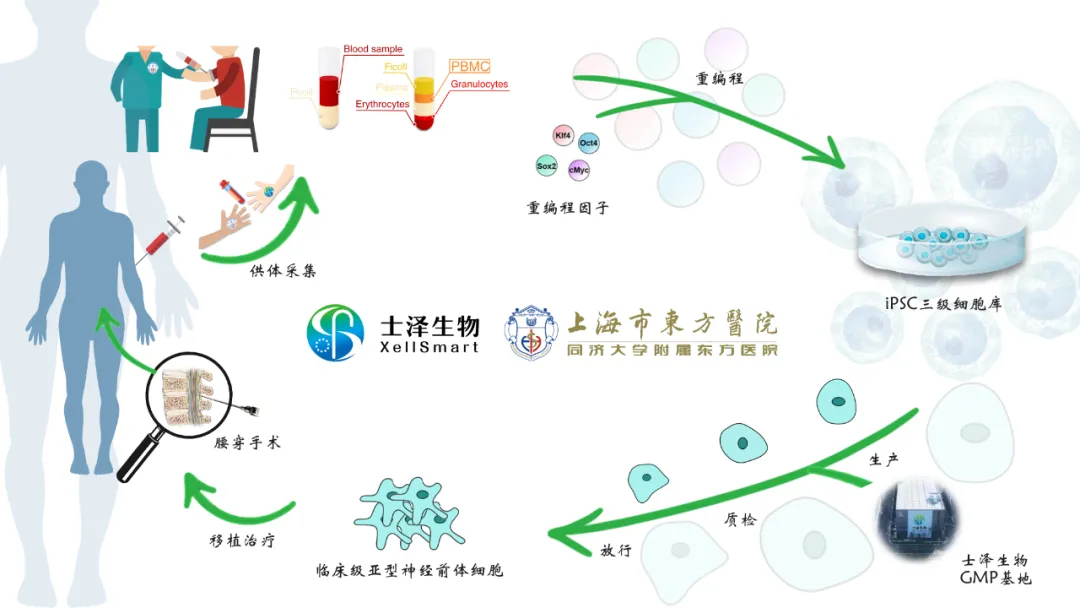
图 | 士泽生物与上海市东方医院临床级iPSC衍生亚型神经前体细胞治疗渐冻症的临床研究启动会正式召开
本次临床研究合作项目由士泽生物与上海市东方医院共同发起,双方将结合各自的优势资源互补协作,充分保障合作项目的开展:


图 | 上海市东方医院刘中民教授及士泽生物创始人李翔出席临床启动会
士泽生物创始人李翔博士(临床研究项目合作方总负责人)表示:
“士泽生物自创立之初,就持续耕耘iPS衍生细胞药治疗帕金森病及渐冻症等具有明确的未被满足的临床需求的神经系统疾病,士泽生物建立了一批具有自主知识产权、国际领先的新技术、新平台,能够为可持续输出自研创新管线提供关键保障:
基于士泽生物已开发的针对渐冻症的iPS衍生细胞药(中国首个自研和国产iPS衍生细胞药获得FDA认证并授予孤儿药资格),士泽生物首先与国内头部医院合作并且已正式启动的针对散发型渐冻症患者的本临床研究、及针对特定突变型的基因修正自体iPS衍生细胞治疗渐冻症的前沿科学临床研究(推荐阅读:士泽生物-北医三院基因修正自体iPS衍生细胞治疗渐冻症临床启动会召开)有望为全球渐冻症患者探索研究和临床验证来自士泽生物的全新治疗策略及方案,为全球渐冻症患者带来新的曙光和希望!
士泽生物团队全职All In,以事实为证,行胜于言,将持续不懈进取、持续结果为证!
国“士”无双的干细胞创新药物,
福“泽”千万受苦难的病患家庭!
上海市东方医院刘中民教授(临床研究项目总负责人)在临床启动会中表示:
“目前全球匮乏能够有效延缓ALS病情进展、延长患者生命的药物,本次与士泽生物强强联合的合作临床研究将推进前沿技术创新和干细胞新药的临床转化,一起力争为中国及全球渐冻症患者做出更大贡献。”
知名渐冻症患者及抗争者蔡磊表示:
"士泽生物是中国甚至全球少有的持续付出和投入开发iPS衍生细胞治疗渐冻症的创新药企!
可喜士泽生物全球首发渐冻症孤儿药已进展至启动临床,我及团队和士泽生物在破冰抗冻道路上一直同行!!"


图 | 上海市东方医院吴景文主任、贾文文主任、何斌主任等出席临床启动会并作发言

图 | 士泽生物与上海市东方医院iPSC衍生亚型神经前体细胞治疗渐冻症临床研究启动会代表合影
渐冻症受试者招募
受试者入组标准:
1.根据修订的EL Escorial标准诊断明确或可能的ALS,筛选时距初次确诊的时间为6~24个月之间;
2.年龄为18~60岁(包含界值),男女不限;
3.患者既往接受过标准治疗后疗效不佳或疾病进展;
4.用力呼气肺活量(FVC)≥50%;
5.男性患者及其配偶和育龄期女性患者应同意从签署ICF开始直至用药后1年内采取有效的避孕措施
6.患者具有良好的依从性。
1.患有严重系统性疾病、自身免疫性疾病、恶性肿瘤或既往有恶性肿瘤史,以及任何其他可能危及患者或干扰研究结果解释的疾病。
2.患有引起颅内高压的脑器质性病变者;
3.被诊断为严重认知障碍、临床痴呆或重大精神疾病;
4.患者有全身炎症或活动性感染
5.既往接受过任何同种异体细胞治疗或组织移植治疗;
6.筛选期前三个月内参加过其他临床研究;
7.经研究者判断,患有其他控制不佳的全身性疾病,或不适合参加本项临床研究的其它情况者
上海市东方医院南院(浦东新区云台路1800号)门诊9号门 功能神经外科
关于士泽生物
士泽生物创始人李翔博士专注iPS衍生细胞创新药的科学研发及产业化十五年,士泽生物长期专注于开发临床级iPS衍生细胞药治疗帕金森病等尚无实质临床解决方案的神经系统疾病:
士泽生物组建了具有国际竞争力及产业界背景的全职团队,士泽生物核心团队成员来自北京大学、清华大学、复旦大学、上海交通大学、同济大学、中国科学院及美国威斯康星大学、霍普金斯大学等海内外著名高校或细胞治疗业界知名公司,团队拥有国际及产业界最前沿的干细胞治疗技术和转化经验。
士泽生物已运营>5000平方米的研发中心、B+A级GMP基地及质控中心,iPS衍生细胞药的主要研发管线已完成核心CMC开发、建立了全流程的临床级制备工艺及质量控制体系,并完成多种临床级iPS衍生亚型特化神经前体细胞治疗产品的正式试生产。
士泽生物临床级iPS衍生多巴胺神经前体细胞治疗帕金森病的首发管线:
已建立全流程的临床级iPS衍生亚型多巴胺能神经前体细胞的工艺及质量控制体系,诱导制备的高纯度亚型特化多巴胺能神经前体神经细胞产品质量标准达国际领先水平,并已在临床前帕金森病小动物模型及中重度帕金森病非人灵长类模型上进行了评估和验证,成药性优异,证实细胞移植治疗安全有效。
2023年,士泽生物从数百家医药企业中脱颖而出,正式入选成为Roche Accelerator在中国的十五家合作成员企业之一。士泽生物正在罗氏体系提供的全球专业顾问团队及配套科学资源的合作支持下,加速推动士泽生物 iPS 衍生细胞治疗帕金森病新药管线的研发和产业化,并入选国家生物药技术创新中心细胞疗法“重点攻关项目”。
2024年1月,士泽生物正式由国家卫生健康委员会与国家药品监督管理局( 简称两委)批准开展iPSC衍生多巴胺能神经前体细胞治疗中重度帕金森病的临床研究,是我国首个经国家两委局正式批准的iPS衍生细胞治疗帕金森病的国家级临床研究,也是我国迄今为止唯一一个正式获批的iPS衍生细胞治疗神经系统疾病的国家级干细胞备案临床研究项目。
士泽生物建立了一批具有自主知识产权、国际领先的新技术、新平台,能够为可持续输出自研创新管线提供关键保障:
2023年,士泽生物自研的全球首发研发管线临床级iPS衍生亚型神经前体细胞治疗渐冻症,获得美国FDA认证授予孤儿药资格并享有获批上市后7年市场独占权等,为中国首个自研和国产iPS衍生细胞药获得FDA认证并授予全球孤儿药资格。
基于士泽生物已开发的针对渐冻症的全球首发iPS衍生细胞孤儿药,士泽生物首先与国内头部医院合作并且已正式启动针对散发型渐冻症患者的临床研究、及针对特定突变型的基因修正自体iPS衍生细胞治疗渐冻症的前沿临床研究。
自李翔博士全职创立士泽生物以来,已完成由峰瑞资本、启明创投、礼来亚洲基金、红杉中国等著名风险投资机构领投的多轮数亿元融资。2022至2023年,在新冠及医药领域整体寒冬的大环境下,李翔博士带领士泽生物完成了由启明创投、礼来亚洲基金、金圆展鸿、中新资本共同领投,元禾控股、北京大学科技成果转化基金、钧山资本、阿里健康和华泰紫金等新股东联合投资的逾两亿元A轮融资及A+轮追加融资。